在上篇《详细解读|冻干注射剂产品制造过程的监管视角》中我们已经介绍与单元操作相关的缺陷,本文中莱奥德创还将为大家描述冻干注射剂产品应用的其他制造方面的监管考虑,包括制造时间、产量、批量和视觉检查。
制造时间
在审查冻干注射剂产品的新药申请批文(NDA)和通用药批文(ANDA)时,一个常见的缺陷与制造操作的时间限制建立有关(见表1)。根据21 CFR 211.111的规定,每个单元操作都需要制定时间限制。从API充装开始的每个操作和总生产时间应包括所有可能的暂停和等待时间,这些时间需要有数据支持(例如化学、物理或微生物数据,取决于适用的情况)。
表 1. 制造时间相关常见缺陷示例
1
API 在溶解到药品配方中时对水解降解敏感,而在较高温度下加快。建立一个最大时限,在混合期间加入API的时间点至冻干循环开始之间。包括证明,药品配方品质在与设备表面接触的最恶劣制造参数(时间、温度等)下将得到保持。
2
药品配方含有有机溶剂,增加了与聚合物组件(过滤器、管道等)接触时产生可溶性杂质的风险。建立在灌装药瓶期间的最大暂停时间,以限制药品配方与制造设备静态接触,并在重新启动灌装操作时执行最小冲洗量。包括证明,这些控制参数足以减轻最终药品中来自制造设备的可溶性杂质的担忧。
产量
在提供的商业生产批记录中对实际生产产量和总协调产量没有明确界定限制,通常会导致发现缺陷,以满足21 CFR 211.103、211.118(b)和211.186(b)的要求。这些实际生产产量限制确保对生产产量中无法解释的差异进行调查,以了解可能对药品质量和安全性产生影响,而协调产量则确保根据21 CFR 211.192进行材料问责。通常发现,在批记录中未定义实际产量限制,缺乏上限控制限制,或者过于宽松,未能捕捉到典型的过程性能。尽管实际产量的接受标准将在过程验证活动期间最终确定,但在提交时,应基于可用的注册批次和稳定批次数据指定临时产量限制。常见与产量相关的缺陷示例可见表2。
表 2. 与产量相关的常见引用缺陷示例
1
在审查主批记录(MBR)时,注意到实际产量和物料对账限制未包含。请根据先前生产批次提出每个制造步骤的实际产量和物料对账限制,以确保工艺的稳健性,并确保用于整个制造过程的材料得到充分核算。相应更新您的MBR;
2
对于冻干制造步骤的实际产量的“不低于40%”的验收标准没有得到注册批次结果的支持,注册批次平均为(98.0 ± 2.0)%。此外,验收标准不包括根据 21 CFR 211.186(b)(7) 所需的上限。加强验收标准并包括上限。
批量大小
药品稳定批次的批量大小应足以确保建立过程能力。虽然ICH指南中未明确定最低稳定批次大小,但在与2014年FDA行业指南相关的问答文件中讨论了最小稳定批次大小。在执行稳定批次时未达到最低批量大小期望值的情况偶尔会在药品申请中观察到。与目标瓶装填量相关的具体批量大小建议可在前述FDA指南中找到。偏离这些指南建议需要适当的理由(见表3)。
表 3. 与批量大小相关的常见引用缺陷示例
1
根据定义的8毫升灌装体积,推荐注册稳定批次的最小批量为30升。我们注意到您的注册批量为7.5升,并计划扩大到75升的商业批次。建议您将商业批量大小修订为与注册批量大小相同,并承诺未来在规模扩大时提供先前批准补充(PAS)。或者,您可以提交适当大小的新注册批次数据。请参阅FDA Industry (2014)关于“ANDAs:药品物质和产品稳定性测试的问题和答案”Q&A#13和#20。
视觉检查
通常情况下,蛋糕外观是冻干药品的关键质量特性之一。有明确定义的蛋糕外观接受标准后,应当建立充分的过程控制措施,以确保蛋糕外观在批内和批间没有显著的变异。视觉检查是冻干操作的关键控制策略元素,因为蛋糕外观出现异常可能会提醒您存在与生产过程有或没有与产品质量属性有关的问题。视觉检查实践通常在检验制造设施时进行审查。有关建立视觉检查程序的指导原则可在USP <790>和<1790>中找到。
在审查申请时,常见的两种缺陷包括:
(1)未能建立典型视觉检查拒绝率或产量限制,从而引发对非典型批次的调查;
(2)未针对注册批次中观察到的视觉检查拒绝率较高的情况提供解释和纠正措施(表4)。
在原始提交中解决这些问题将有助于证明已经建立了足够的控制措施,以便检测和处理冻干药品可能存在的质量缺陷。
表 4. 与批量大小相关的常见引用缺陷示例
1
更新商业生产批记录(MBR),包括在100%视觉检查期间获得的拒绝数量限制;
2
在注册稳定批次#1的视觉检查中发现了高比例的拒绝(12%)。解释被拒绝药品的原因,并描述将在商业规模实施的改正措施,以减少后续批次的拒绝数量。
关于后续批准补充的考虑
除了调查了263份监管提交外,OPMA在撰写本报告时分析了共453份后续许可补充。如图1所示,根据2004年FDA行业指南,对每份补充进行了分析,并分为七个类别。与本研究的主题一致,在图1中应更加重视制造过程,这占总体调查补充的25%。发现在产品批准后的前两年内,大多数后续许可补充与制造过程相关。值得一提的是,通过在开发过程中对产品和制造过程设计进行更全面的了解,一些这些补充本可以避免。
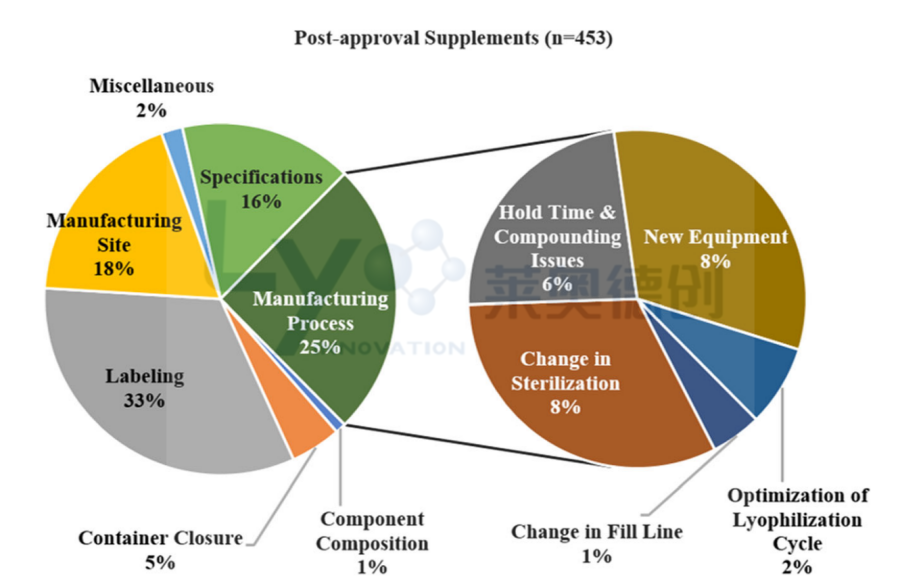
图1:共有453份与360份ANDA和93份NDA相关的后续批准补充被分类为七个类别,其中包括将制造过程进一步细分为五个分类
结论
本文讨论了与冻干注射产品制造过程相关的潜在风险。基于对从263份监管提交中确定的与制造有关的缺陷的了解,对生产冻干注射产品所需的单元操作给出了一般建议。总之,本文提供的信息可能有助于制药行业将质量要求融入未来的监管提交中,从而加快审查和批准流程,并最终使医学上非常重要的冻干注射产品及时面向公众。
1
莱奥德创冻干技术分享
关注“莱奥德创冻干工场“,立即获取更多冻干线上技术分享内容。
基于对于冻干研发的一些考量,莱奥德创创建了金字塔冻干技术分享平台:包含了从冻干理论基础,到配方和工艺开发,再到放大及生产,以及进阶的设备管理和线上线下专题内容分享。
内容结合了来自Biopharma的冻干理论指导体系、来自于莱奥德创产品经理及应用工程师的实践经验总结及国内外专家的专题内容。
获取方式
Step 1:关注公众号

扫码关注
莱奥德创公众号
Step 2:点击菜单栏“冻干讲堂”
Step 3:点击你感兴趣的内容Banner
Step 4:开始学习
 如果您对上述服务感兴趣,可随时联系德祥科技或莱奥德创,可拨打热线400-006-9696,或扫码填写表单咨询。
如果您对上述服务感兴趣,可随时联系德祥科技或莱奥德创,可拨打热线400-006-9696,或扫码填写表单咨询。

参考文献:
[1] A Regulatory Perspective on Manufacturing Processes Pertaining to Lyophilized Injectable Products
关于莱奥德创冻干工场
上海莱奥德创生物科技有限公司专注于提供先进的冻干设备应用和制剂开发相关服务,依托于合作伙伴加拿大ATS集团SP品牌和英国Biopharma Group等的紧密合作,致力于促进中国生物医药技术创新升级,助力中国大健康行业的持续发展。莱奥德创在上海及广州设有实验室,拥有专业的技术团队及国内外专家支持体系。
莱奥德创面向生物制药、食品科学等各个领域行业客户,提供冻干研发、放大、委托生产及培训等服务。
前期研发
● 产品配方特征研究:共晶点温度(Te)、塌陷温度(Tc)、玻璃态转化温度(Tg'、Tg)测定等;
● 实验室工艺开发:冻干工艺开发:冻干制剂配方开发,工艺确定,申报材料撰写;
● 冻干工艺优化:利用中试冻干机上独家PAT工具优化及缩短工艺;
● 冻干产品质量指标测试:水分含量,冻干饼韧度分析;
● 咨询服务:如产品外观问题、产品质量问题、其他troubleshooting等;
工艺放大/技术转移
● 冻干工艺转移/放大: 远程技术指导+现场服务;
● 小批量冻干生产(NON-GMP),临床一期生产(GMP);
其他业务
● 企业小团队线上线下培训服务:冻干原理,工艺开发,设备使用维护等;
● 冻干设备租赁服务。
400-006-9696
www.lyoinnovation.com
莱奥德创冻干工场
中国(上海)自由贸易试验区富特南路215号
自贸壹号生命科技产业园4号楼1单元1层1002室
德祥科技
德祥科技有限公司成立于1992年,总部位于中国香港特别行政区,分别在越南、广州、上海、北京设立分公司。主要服务于大中华区和亚太地区——在亚太地区有27个办事处和销售网点,5个维修中心和2个样机实验室。
30多年来,德祥一直深耕于科学仪器行业,主营产品有实验室分析仪器、工业检测仪器及过程控制设备,致力于为新老客户提供更完善的解决方案。公司业务包含仪器代理,维修售后,实验室咨询与规划,CRO冻干工艺开发服务以及自主产品研发、生产、销售、售后。与高校、科研院所、政府机构、检验机构及知名企业保持密切合作,服务客户覆盖制药、医疗、商业实验室、工业、环保、石化、食品饮料和电子等各个行业及领域。
2009至2021年间,德祥先后荣获了“最具影响力经销商”、“年度最佳代理商“、”年度最高销售奖“等殊荣。我们始终秉承诚信经营的理念,致力于成为优秀的科学仪器供应商,为此我们从未停止前进的脚步。
我们始终相信,每一天都在使这个世界变得更美好!










